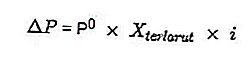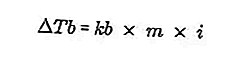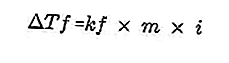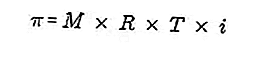حاول الانتباه إلى ما هو حولنا يتعلق بالكيمياء؟ الأسهل هو الهواء الذي نتنفسه ، والذي يحتوي على مزيج من الأكسجين والنيتروجين والغازات الأخرى. توابل الطعام ، وملونات الطعام ، والمواد الحافظة هي أيضًا أمثلة أخرى للمواد الكيميائية الموجودة حولنا. الكيمياء هي فرع من فروع العلوم الطبيعية ستدرسه في المدرسة التي تدرس مواد مختلفة ، ومن الأمثلة على ذلك بنية المادة ، وخصائص المادة ، وشكل المادة ، والتغيرات في المادة ، وتصنيف المادة ، وتكوين المادة ، والطاقة التي تصاحب هذه التغييرات. ليس فقط الرياضيات والفيزياء ، للكيمياء أيضًا أنواعًا مختلفة من الصيغ ، كما تعلم. هناك العديد من الصيغ الكيميائية التي ستتعلم منها ، من الخصائص التجميعية إلى تفاعلات الأكسدة والاختزال.
في هذه المناسبة سوف نتعلم العديد من الصيغ الكيميائية وأيضًا أمثلة على مشاكلها والتي ستساعدك على فهم مفاهيم الصيغ الكيميائية.
الصيغ الكيميائية وأمثلة المشاكل
إن وجود الصيغ في الكيمياء يساعد الباحثين في العثور على أنواع مختلفة من النتائج التجريبية التي سيتم تنفيذها. لتكون قادرًا على إتقان هذا العلم جيدًا ، يجب أن تعرف بعض الصيغ الكيميائية التي ستواجهها غالبًا عند دراسة الكيمياء.
صيغة للخصائص التجميعية للحلول
تعتبر الطبيعة الترابطية للمحلول سمة من سمات المحلول الذي لا يعتمد على نوع مادة قابلة للذوبان ولكنه يعتمد فقط على تركيز جزيئات المحلول. ثم تتكون الطبيعة التجميعية للحل من نوعين من الخصائص ، وهما الطبيعة التجميعية لمحلول الإلكتروليت والطبيعة التجميعية للمحلول غير المنحل بالكهرباء.
- الخصائص المجمعة للحلول غير المنحل بالكهرباء
على الرغم من أن الطبيعة التجميعية تنطوي على حل ، فإن الطبيعة التجميعية لا تعتمد على تفاعل الجزيئات المذابة والمذابة ، ولكن مع كمية المذاب المذاب في المحلول. تتكون الخواص التجميعية من انخفاض ضغط البخار ، وزيادة درجة الغليان ، وانخفاض نقطة التجمد ، والضغط الاسموزي. كل واحد يتطلب صيغة كيميائية للحصول على النتيجة.
- معادلة انخفاض ضغط البخار

المصدر: format.co.id
- معادلة زيادة نقطة الغليان
نقطة غليان السائل هي درجة الحرارة الثابتة التي يغلي عندها. عند درجة الحرارة هذه ، يكون لضغط بخار السائل معادلة في ضغط الهواء المحيط به وينجم عن تبخر جميع أجزاء السائل. يمكن قياس نقطة غليان السائل بضغط 1 جو.
الفرق في نقطة غليان المحلول ونقطة غليان المذيب النقي يسمى الزيادة في نقطة الغليان ، ومعادلة الزيادة في نقطة الغليان هي:

المصدر: format.co.id
- معادلة اشتقاق نقطة التجمد
المذاب الموجود في المحلول سيجعل نقطة تجمد المحلول أصغر من نقطة تجمد المذيب. معادلة تخفيض درجة التجمد:

المصدر: format.co.id
- الضغط الاسموزي
الضغط الاسموزي هو القوة المطلوبة لموازنة ضغط المذيب من الغشاء شبه القابل للنفاذ عبر المحلول.
الغشاء شبه القابل للنفاذ هو غشاء يمكن أن تمر من خلاله جزيئات المذيب ، لكن المواد المذابة لا يمكن أن تمر من خلاله. وفقًا لـ Van't Hoff ، عند الضغط الاسموزي ، يتم صياغة المحلول على النحو التالي:

المصدر: format.co.id
- الخصائص التجميعية لمحاليل الإلكتروليت
في التركيز ، تكون للخصائص التجميعية لنفس محلول الإلكتروليت قيمة أكبر عندما نقارنها بالخصائص التجميعية للمحلول غير المنحل بالكهرباء. لأن العدد الكبير من الجسيمات الذائبة ينتج عن تفاعل التأين لمحلول الإلكتروليت الذي تمت صياغته في عامل Van't Hoff.
سيتم دائمًا ضرب حساب الخصائص التجميعية لمحاليل الإلكتروليت بواسطة عامل Van't Hoff على النحو التالي:

المصدر: format.co.id
بعض الصيغ الخاصة بالخصائص التجميعية لمحاليل الإلكتروليت الأخرى هي:
- انخفاض ضغط البخار
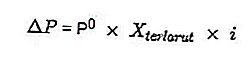
المصدر: format.co.id
- زيادة نقطة الغليان
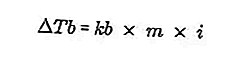
المصدر: format.co.id
- انخفاض نقطة التجمد
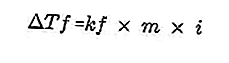
المصدر: format.co.id
- الضغط الاسموزي
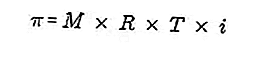
المصدر: format.co.id
صيغ المولارية والمولالية والكسور الجزيئية
مولارية (م)
المولارية هي عدد مولات مادة مذابة في لتر واحد من المحلول.

المصدر: format.co.id
م = المولارية
Mr = الكتلة المولية للمذاب (جم / مول)
V = حجم المحلول
مولالي (م)
المولالية هي عدد مولات المادة المذابة في 1 كجم من المذيب. الصيغة الكيميائية على النحو التالي.

المصدر: format.co.id
م = مولالية (مول / كغ)
Mr = الكتلة المولية للمذاب (جم / مول)
الكتلة = كتلة المذاب (جم)
P = كتلة المذيب (جم)
جزء مول
الكسر المولي هو وحدة تركيز يتم فيها حساب جميع مكونات المحلول بناءً على عدد المولات.

المصدر: format.co.id
xi = عدد الشامات
i، j، xj = الكسر الجزيئي
أمثلة على مشاكل الصيغة الكيميائية
1. إذا كان الضغط الاسموزي 500 مل من محلول الفركتوز ، C6H12O6 من 32 درجة مئوية هو 2 ضغط جوي ، فإن كمية كتلة الفركتوز المذابة هي؟
المحلول:

2. في جزء الخلد من محلول اليوريا في الماء 0.2. ضغط البخار المشبع من الماء النقي بدرجة حرارة 20 درجة مئوية 17.5 مم زئبق. ثم عند المحلول ضغط البخار المشبع عند درجة الحرارة التالية؟
X يوريا + ماء X = 1
0.2 + X ماء = 1
X ماء = 0.8
محلول P = ماء X P ماء
P من المحلول = 0.8 × 17.5 مم زئبق
P من المحلول = 14 مم زئبق
هذه بعض الصيغ الكيميائية التي يمكنك تعلمها لتسهل عليك الإجابة على أنواع مختلفة من أسئلة الكيمياء. إذا كنت تشعر أن هذه الصيغ غير كافية ، فيمكنك تجربة منتج PROBLEM ، وهو حل تمرين مرجح وكامل عبر الإنترنت للفئة الذكية مثل علم المثلثات والحد واللوغاريتم وغيرها الكثير. بدءاً من المرحلة الابتدائية والإعدادية وحتى الثانوية بمواد مختلفة مثل الرياضيات والفيزياء والكيمياء وغيرها. هنا يمكنك التعرف على أنواع مختلفة من الصيغ كاملة مع أمثلة على المشكلة.
هيا، ماذا تنتظرون! لنجرب تمارين PROBLEM في Smart Class الآن.